Fosterdiagnostik 2
|
||||||||||||||||||||||||||
| 1. Introduktion | ||||||||||||||||||||||||||
|
Modern fosterdiagnostik har funnits sedan slutet av 1960-talet då man introducerade fostervattenprov, odling av fosterceller för kromosomanalys och biokemisk analys för diagnos av vissa nedärvda sjukdomar. Fosterdiagnostiken är nu en integrerad del av mödrahälsovården och i dag ska t.ex. varje gravid kvinna i Sverige erbjudas information om tillgängliga metoder för fosterdiagnostik inklusive deras risker och begränsningar. Fosterdiagnostik kan delas in i två delar, dels det allmänna fosterdiagnostikerbjudandet (fosterscreening) med ultraljud för att detektera missbildningar samt olika metoder för att identifiera foster med kromosomavvikelse, dels riktad fosterdiagnostik i de fall det föreligger en hög individuell risk, tex en ärftlig sjukdom.
Ett viktigt syfte med fosterdiagnostik är att erbjuda ytterligare en valmöjlighet för kvinnor eller par med känd ökad risk att få barn med vissa allvarliga genetiskt betingade sjukdomar. Genom att kunna konfirmera frånvaro av en specifik sjukdom hos det väntade barnet vågar dessa kvinnor bli gravida eller fortsätta en pågående graviditet. I andra fall möjliggör fosterdiagnostiken optimerat omhändertagande eller behandling av den blivande modern och ibland också av det sjuka fostret. Information om risken för missfall vid invasiv fosterdiagnostik, de diagnostiska metodernas inneboende begränsningar samt konsekvenserna av ett avvikande fynd kräver en detaljerad och omsorgsfull information som bäst ges i samband med genetisk vägledning innan fosterdiagnostik genomförs.
Fosterdiagnostik kan aldrig garantera ett friskt barn, endast utesluta vissa typer av sjukdomar och skador. Det finns ett stort antal skador som kan diagnostiseras prenatalt, men de flesta är utomordentligt sällsynta. För den allmänna populationen är risken 2-3% att få ett barn med en allvarlig skada eller psykisk utvecklingsförsening. Viktiga grunder för ställningstagande till fosterdiagnostik inkluderar: · en bedömning om en risk föreligger att få ett barn med en genetisk betingad skada (missbildning, kromosomrubbning eller monogen sjukdom). · om möjlighet finns till bärardiagnostik eller screeningtest för att bättre kunna definiera denna risk. · vilka behandlingsmöjligheter är tillgängliga för den aktuella skadan och det förväntade utfallet av behandlingen. · om skadan går överhuvud att diagnostisera prenatalt, vad är provtagningsrisken och säkerheten av den diagnostiska metoden · samt, viktigast, vilken attityd och vilka önskemål den gravida kvinnan eller paret har med avseende på risken för att få ett sjukt barn och om man vill utnyttja fosterdiagnostik.
| ||||||||||||||||||||||||||
| 2. Invasiva provtagningsmetoder | ||||||||||||||||||||||||||
|
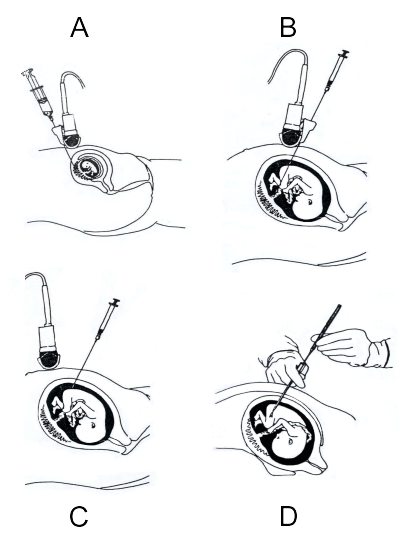
Både invasiva och icke-invasiva metoder används för fosterdiagnostik (Tabell 1). Invasiva prover inkluderar moderkaksprov (korionvillibiopsi), fostervattenprov (amniocentes), fetalt blodprov (cordocentes) och mer sällan, biopsier på andra fostervävnader och fetoskopier för direkt undersökning av fosteranatomi (Figur 1). I Sverige genomgår ungefär 3–5 procent av alla gravida kvinnor ett moderkaks- eller fostervattenprov.
Tabell 1. Metoder för fosterdiagnostik och risker för missfall utöver bakgrundsrisken.
Figur 1. Några invasiva metoder för fosterdiagnostik. A. Transabdominellt moderkaksprov B. Perkutant fetalt blodprov (cordocentes) C. Fostervattenprov D. Fetal hudbiopsi.
Moderkaksprov Vid moderkaksprov sticker man en tunn nål genom bukväggen in i livmodern och tar en mindre mängd moderkaksvävnad för analys. Provet kan tas från vecka 10. Förekomst av mosaicism, dvs celler med olika kromosomuppsättningar i samma prov kan vara en komplicerande faktor. Mosaicism i enbart moderkakan (“confined placental mosaicism”) och inte hos fostret påvisas i ca 1-2 % av moderkaksprov (Figur 2), men leder sällan till missvisande diagnostik eftersom mosaicismen vanligen upptäcks vid analysen. Vid fynd av mosaicism krävs vanligen kontroll med ett fostervattenprov och i sällsynta fall genom ett fetalt blodprov.
Figur 2. Mosaicism i enbart moderkaka (confined placental mosaicism, CPM). De tre typerna av CPM illustreras i mitten av figuren. Uniparental disomi kan uppstå för den kromosom som är trisomisk i moderkakan genom förlust av en av homolog kromosom (sk ”trisomy rescue” se figur 3); effekten på fostret beror på om genomisk imprinting för denna kromosom eller vissa gener på denna kromosom föreligger eller ej. Fostervattenprov Fostervattenprov går till på ungefär samma sätt som moderkaksprov, men analysen görs istället på celler i fostervattnet (amniocyter). Provet tas vanligen från graviditetsvecka 15. Moderkaksprov liksom fostervattenprov medför en ökad risk för missfall motsvarande 0,1–0,5 procent (Tabell 1). Mosaicism, förekommer även i fostervattenprov, men i lägre utsträckning. Analys av annan fostervävnad (fosterblod) är ibland nödvändig för att säkerställa diagnosen. Incidensen av mosaicism vid fostervattenprov har funnits vara 0.1-0.3 % i stora studier.
Faktaruta Maternell cellkontaminering Maternell cellkontaminering har regelbundet observerats i fostervattenprov från graviditeter, särskilt där moderkakan ligger i framväggen. Förekomst av maternella celler anses därför för det mesta härstamma från stickblödningar vid provtagning. Vid en stor europeisk multicenterstudie av fostervattenprov var incidensen av maternell cellkontaminering i genomsnitt 0,17 % (79/45 806) med en stor variation bland de olika centra (variationsvidd 0-1,37%) tydande på tekniska faktorer. Maternell cellkontaminering leder sällan till något diagnostiskt problem när den upptäcks vid kromosomanalys, men om en överväxt av dessa celler sker vid en cellodling kan det leda till en felbedömning av fostrets kön och kromosomuppsättning (Figur 3). Fel könsangivelse efter ett fostervattenprov inträffar i genomsnitt i 0.11% (40/ 36 718; variationsvidd 0-1.5%). Denna frekvens torde ligga lägre idag pga bruk av för fostercelltillväxt mer selektiva cellodlingsmedier. Till detta bidrar även introduktionen av QF-PCR (se nedan), en metod som mer tillförlitligt diagnostiserar maternell kontamination och gör att fler fall av maternell kontamination upptäcks. Risken för maternell cellkontaminering är högre vid ett moderkaksprov än vid ett fostervattenprov pga av anatomiska förhållanden (direktkontakt mellan livmoder och moderkaka). I praktiken utgör detta sällan något problem när provtagare har stor erfarenhet av moderkaksprov och laboratoriet har stor vana att hantera dessa prov (provrensning under dissektionsmikroskop).
| ||||||||||||||||||||||||||
| 3. Fosterscreening | ||||||||||||||||||||||||||
|
Ultraljudsundersökning I Sverige erbjuds alla gravida kvinnor ultraljudsundersökning för att bestämma graviditetslängd, upptäcka flerbörd och systematiskt granska fostrets anatomi. Undersökningen har med tiden fått en ökad betydelse för upptäckt av fetala missbildningar hos kvinnor utan tidigare känd risk. Vid fynd av fetala missbildningar gör man vanligen en kromosomanalys av fosterceller (se nedan), eftersom upp till 30 % av missbildningar visar sig orsakas av en kromosomavvikelse, se nedan. I vissa fall kan det vara av vikt att få veta om ett foster har en missbildning utan att man för den skull avser att avbryta graviditeten. Man kan då optimera det obstetriska omhändertagandet genom att planera tidpunkten för förlossning, var den ska ske samt förlossningssätt. Det finns också ett fåtal tillstånd som med fördel kan behandlas prenatalt. Screening för kromosomavvikelse Det har länge varit känt att sannolikheten att få ett barn med trisomi 21 (Downs syndrom) ökar med stigande ålder hos modern. Notera att denna risk är högre vid tidpunkten för ett fosterprov än vid förlossningen eftersom flertalet foster med en kromosomrubbning spontant aborteras eller dör in utero senare under graviditeten. Denna kunskap ledde till att kvinnor över en viss ålder erbjöds fosterprov för kromosomanalys av fostret. Av födda barn med Downs syndrom har dock omkring två tredjedelar mödrar som är yngre än 35 år. Den relativt låga sensitiviteten när man använder moderns ålder som riskindikator för kromosomavvikelse, samt missfallsrisken vid fostervattenprovet, har lett till att nya urvalsmetoder har utvecklats. En fördel med att använda de nya urvalsmetoderna för att identifiera en riskgrupp är att antalet fosterprov och därmed associerade missfall blir lägre.
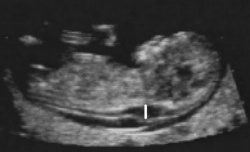
KUB - kombinerat ultraljud och biokemi Den vanligaste screeningmetoden i dag är ett kombinerat test under graviditetsveckorna 10–14, s.k. KUB, en undersökning som används för att beräkna sannolikheten för att ett foster har trisomi 13, 18 eller 21. KUB omfattar ultraljudsmätning av fostrets nackuppklarning (Figur 3), två biokemiska serummarkörer i maternellt blod (fritt beta-hCG, humant koriongonadotropin och PAPP-A, pregnancy-associated plasma protein A) samt risken för trisomi 21 som betingas av moderns ålder. KUB ger en detektion (sensitivitet) för trisomi 21 på ungefär 86 % vid cirka 5 % positiva screeningstest i en oselekterad population. Fritt beta-hCG ligger i medeltal två gånger högre och PAPP-A i medeltal 40–50 % lägre vid graviditet med trisomi 21 jämfört med graviditet med normal kromosomuppsättning hos fostret
Figur 3: Mätning av nackuppklarning hos fostret (vitt streck) i graviditetsvecka 10-13. Notera vätskespalten i nacken (”NUPP”).
Resultatet av KUB är enbart en sannolikhetsbedömning. Ett test bedöms som positivt om resultat anger en risk att få ett barn med trisomi 21 som överstiger ett visst gränstal (”cut-off risken”, tex 1/200). Om man vill ha ett säkert besked om kromosomförändringar hos fostret måste man göra ett fostervattenprov eller moderkaksprov (ett diagnostiskt prov). Sensitiviteten för KUB anges till ca 85% för trisomi 21 och det positiva prediktiva värdet (PPV) till 5-10%. Dvs att om ens prov hamnar över gränsvärdet så är det maximalt 10% risk att fostret verkligen har en kromosomavvikelse. Därför erbjuds man vid positivt test ett moderkaksprov eller fostervattenprov. Ett alternativ till det invasiva provet är NIPT, se nedan.
KUB erbjuds i majoriteten av Sveriges landsting. Några landsting erbjuder undersökningen till alla gravida, och andra erbjuder den enbart till gravida kvinnor över en viss ålder, oftast 35 år.
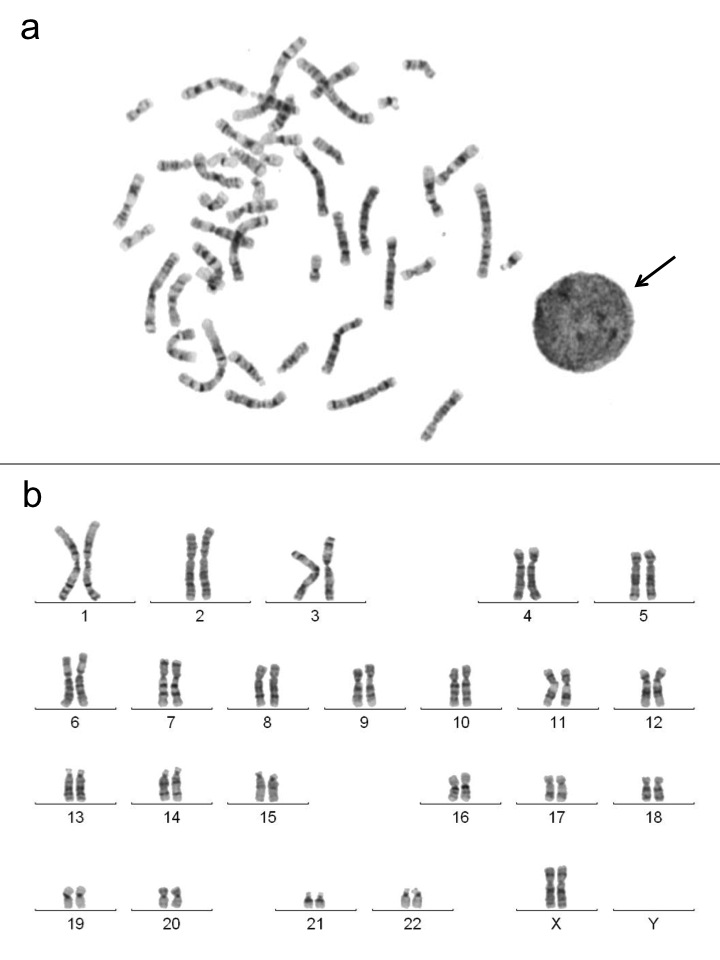
Kromosomanalys Sedan fosterdiagnostik för kromosomavvikelser introducerades i början av 1970-talet har denna baserats på en fullständig kromosomanalys och karyotypering av fostervattenceller, och senare även av moderkaksceller när moderkaksprov taget i första trimestern introducerades i mitten av 1980-talet. Kromosomanalys på odlade fostervatten- och moderkaksceller har en stor diagnostisk säkerhet, och metoden används därför rutinmässigt vid samtliga kliniskt genetiska avdelningar i Sverige och de flesta genetiska laboratorier utomlands där fosterdiagnostik bedrivs. Fullständig kromosomanalys kräver att cellerna odlas och därefter blockeras i metafasstadiet eftersom kromosomerna först då kan analyseras på ett tillfredsställande sätt med hjälp av olika kromosombandningstekniker (Figur 4, karyotyp). Med denna analys kan man påvisa numeriska kromosomavvikelser, sk aneuploidi, som tex en trisomi. Men även förlust eller tillkomst av kromosommaterial kan detekteras, förutsatt att de är av en storlek som kan detekteras vid mikroskopi. Kromosomanalys på odlade fostervattenceller har en mycket hög diagnostisk säkerhet på 99.4-99.8%. Även kromosomanalys på odlade moderkaksceller (korionvilli) har en hög diagnostisk säkerhet på 97.5-99.6 %. Det tar som regel 11–14 dagar innan svaret på en kromosomanalys på fosterceller är klart. En väntetid som upplevs negativt av många par.
Figur 4: Human kromosomuppsättning (kvinnlig) a) I varje cell i vår kropp finns en cellkärna och i den finns våra kromosomer. Kromosomerna innehåller i sin tur våra gener. Kromosomerna går inte att urskilja när cellen befinner sig i vilofas (se pil), men när cellen går in i delningsfas drar kromosomerna ihop sig och blir då synliga om man tittar i mikroskop. b) Människan har normalt 46 kromosomer som kan delas in i 23 par. I varje par har vi ärvt den ena kromosomen från vår mamma och den andra från pappa. Det sista paret, könskromosomerna, skiljer sig åt mellan könen. Kvinnor har normalt två X-kromosomer, XX, medan män har en X och en Y kromosom, XY.
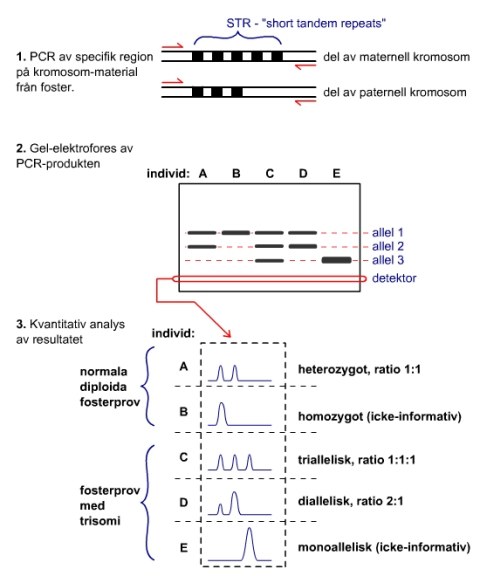
Riktad kromosomanalys för snabb analys avseende aneuploidi För kromosomanalys tar det ungefär 14 dagar och ibland längre innan ett svar föreligger. Det finns ett önskemål från alla parter om ett snabbt svar vid fosterdiagnostik. Kvantitativ fluorescent polymeraskedjereaktionsteknik (QF-PCR) innebär molekylär amplifiering av repeterade sekvenser i olika polymorfa lokus på till exempel kromosom 13, 18, 21 samt könskromosomerna (Figur 5-6). QF-PCR på fostervatten- eller moderkaksceller tillåter ett svar inom 1-2 dagar för de vanligaste numeriska kromosomavvikelserna (trisomi 21, trisomi 18, trisomi 13 och könskromosomavvikelser). Denna metod identifierar således endast numerära avvikelser av dessa utvalda kromosomer och ibland mindre strukturella avvikelser på dessa kromosomer Avvikelser på andra kromosomer kommer inte att detekteras. Fördelen med QF-PCR är att metoden kräver en mindre mängd fosterceller, är mindre arbetskrävande därmed billigare än tidigare använda metoden interfas-FISH. QF-PCR har därför blivit rutinmetoden för snabbt svar på de vanligaste kromosomavvikelserna vid fosterdiagnostik. En annan fördel med QF-PCR analys är att man kan upptäcka maternell cell-kontaminering, vilket kan vara omöjligt att diagnostisera med kromosomanalys när fostret är kvinnligt.
Figur 5: Princip för QF-PCR. Pilarna i steg ett hänvisar till polymeraskedjereaktionsteknik.
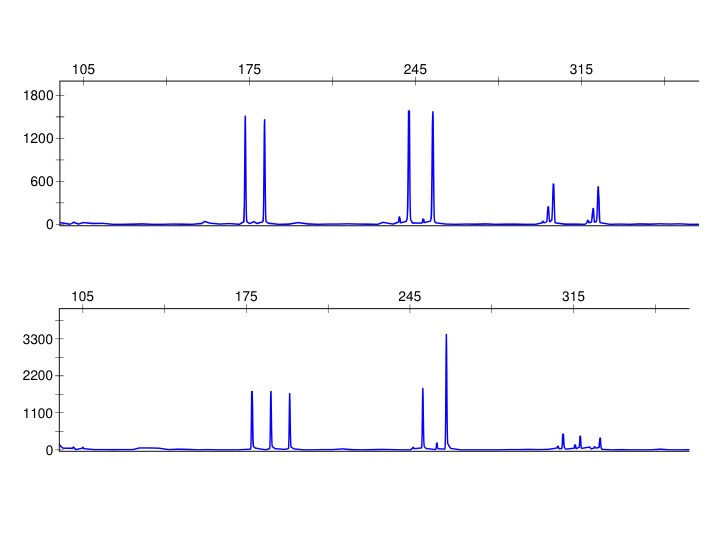
Figur 6: Bilden visar resultatet för kvantitativ fluorescent polymeraskedjereaktion (QF-PCR) analys på fosterceller med tre olika polymorfa markörer på kromosom 21. De två (eller tre) topparna för respektive markör representerar var sin allel. Fosterprovet i övre raden visar två toppar för vardera markör, vilket motsvarar två stycken kromosom 21, d.v.s. normalt. Undre raden visar ett foster som har tre alleler för vardera markör (topparna antingen i förhållandet 1:1:1 eller i förhållandet 2:1), vilket betyder att detta foster har tre kromosom 21, dvs trisomi 21 (Downs syndrom).
Icke invasiv fosterdiagnostik (non-invasive testing, NIPT) för kromosomavvikelser NIPT innebär att fosterdiagnostik kan göras utan att man behöver ta prov från moderkakan eller fostervattnet. Vid NIPT tas ett blodprov från den gravida kvinnan och analysen bygger på att det i blodet hos den gravida kvinnan finns en liten mängd cellfritt DNA (cfDNA) från fostret som kan användas för genetisk analys. Analys av cfDNA i ett blodprov kan användas för olika typer av fosterdiagnostik. I Sverige används metoden sedan många år för analys av fostrets blodgrupp. NIPT för diagnostik av kromosomavvikelser håller på att introduceras i Sverige. I detta avsnitt behandlar vi endast NIPT för kromosomavvikelser Metod Cellfritt DNA (cfDNA) finns i blodet hos oss alla som ett resultat av att celler bryts ner och nybildas. Under graviditeten sker det nybildning och nedbrytning av celler i moderkakan vilket leder till en frisättning av korta bitar cellfritt DNA från fostret till mammans blod. Under graviditetsperioden ökar mängden cellfritt DNA från fostret och från graviditetsvecka 10 är andelen cfDNA som kommer från fostret normalt 10-20%. Från blodets plasma hos modern isoleras cellfritt DNA och efter ytterligare beredning och rening utförs massiv parallellsekvensering av DNA-provet. Resultatet består av flera miljoner korta ”läsningar” från samtliga kromosomer där en andel av läsningarna kommer från fostret. Om fostret har en trisomi (extra kromosom) för någon av kromosomerna som analyseras kommer det leda till en ökning av DNA-fragment från den kromosomen jämfört med ett antal referenskromosomer vilket möjliggör detektionen. Vid NIPT för kromosomavvikelser kan blodprovet vanligen tas tidigast i graviditetsvecka 10+0 men denna gräns kan variera mellan olika laboratorier. Faktaruta Mer om metoden Blodplasma innehåller cfDNA, det vill säga DNA som inte är bundet till cellkärnan. Hos gravida kvinnor härstammar en del av detta DNA från fostret (cellfritt fosterDNA, cffDNA) och denna del utgör också den så kallade fetala fraktionen av allt cellfritt DNA i blodbanan. CffDNA har sitt ursprung i celler från moderkakan och kan identifieras redan från graviditetsvecka fyra, dvs två veckor efter befruktningen. Från graviditetsvecka 10 så räknar man med att den fetala fraktionen hos en stor andel av de gravida har nått cirka 10 procent. Även hos de med en lägre fetal fraktion så har den i de flesta fall nått en nivå av >4 procent som brukar räknas som den lägre gränsen för att lyckas med NIPT för diagnostik av kromosomavvikelser. Därför rekommenderas NIPT vanligen från tidigast 10 fullgångna graviditetsveckor. Mängden cffDNA beror på flera faktorer. En av faktorerna som påverkar den fetala fraktionen är gravida kvinnans vikt där överviktiga kvinnor har ofta en lägre fetal fraktion än normalviktiga kvinnor. CffDNA består av relativt korta DNA-fragment men hela det fetala genomet finns representerat. Det har en kort halveringstid och är strax efter förlossningen inte spårbart, vilket ger en säkerhet att analysen gjorts på DNA från fostret i den aktuella graviditeten och inte på DNA från fostret i en tidigare graviditet. Analysmetoden vid NIPT för kromosomavvikelser baseras på en utveckling av DNA-sekvenseringsteknologin, så kallad massiv parallell (shotgun) sekvensering (MPSS). Det är i dagsläget tre olika tillvägagångssätt som används kliniskt. Genom att märka det enskilda DNA-fragmentet möjliggörs sekvensering av flera prover samtidigt vilket är nödvändigt för att metoden ska bli mer kostnadseffektiv. Skillnaden mellan de olika metoderna ligger i vilka DNA-fragment som sekvenseras, det vill säga om man utför en generell analys av hela genomet eller en riktad analys av specifika kromosomer. 1) Massiv parallell (shotgun) sekvensering (MPSS). Miljontals DNA-fragment från hela genomet sekvenseras samtidigt och fragmenten matchas mot en etablerad referenssekvens för det humana genomet. Man kan därför knyta varje fragment till dess specifika kromosom. Antalet fragment från respektive kromosom jämförs sedan mot antal fragment för flera referensregioner i hela genomet för att få ett mått på överskottet. Om provet innehåller DNA från ett foster med trisomi 21 kommer det att finnas ett litet överskott av fragment från den kromosomen. 2) A. Riktad (targeted) massiv parallell sekvensering (t-MPS). Med hjälp av ett selektionssteg innan sekvenseringen kan man välja att endast sekvensbestämma fragment från de kromosomer som är av intresse, till exempel kromosom 13, 18 och 21. Man väljer då flera hundra regioner från varje kromosom som är extra lämpade för sekvensering. Liksom i exemplet ovan jämförs antalet fragment med referensregioner för att vid en trisomi detektera ett överskott av fragment från den kromosomen. Eftersom det totala antalet fragment som analyseras är lägre än vid MPSS blir metoden billigare både att sekvensera och analysera. B. En annan form av riktad MPS använder förekomsten av enbaspolymorfismer i genomet, SNPs (eng. Single Nucleotide Polymorphisms). Vid SNP-baserad analys väljs fragment från dessa polymorfa regioner på de kromosomer som är av intresse. Flera tusen regioner per kromosom sekvenseras och jämförs med sekvenseringsresultatet från genomiskt DNA som istället isolerats från celler i mammans blod. Man kan då med större säkerhet få fram hur fostrets DNA-sekvens ser ut för dessa regioner och även se om det föreligger en förändring i antalet kopior av de fetala kromosomerna jämfört med mammans. De ovan nämnda tillvägagångssätten har olika fördelar och nackdelar, till exempel vid graviditeter med speciella förutsättningar såsom vid tvillinggraviditet och äggdonation. I de allra flesta fall är dock metoderna i stort sett likvärdiga. Flest studier är gjorda med MPSS, följt av t-MPS och SNP-baserad analys. Det finns dock även andra metoder för analys av cffDNA som har utvärderats men ännu inte implementerats i klinisk diagnostik. NIPT för kromosomavvikelser NIPT används vanligen som en riktad analys för att påvisa trisomi 21 (Downs syndrom), trisomi 13 (Pataus syndrom) och trisomi 18 (Edwards syndrom). Testet kan också ge information om fostrets könskromosomer X och Y inklusive om det finns någon avvikelse i antalet könskromosomer, till exempel som vid Turners eller Klinefelters syndrom. Vad som ingår i analysen kan dock variera mellan olika laboratorier. Hur säkert är testet? Om NIPT-analysen visar på en kromosomavvikelse (ett positivt testresultat) betyder det att det finns en förhöjd sannolikhet för kromosomavvikelse hos fostret. Men detta måste bekräftas med ett fostervattenprov eller moderkaksprov eftersom avvikande resultat kan förekomma även om fostret är friskt (så kallat falskt positivt resultat). I dagsläget räknar man med att ca vart 5:e (20%) positivt prov är falskt positivt. Om NIPT-analysen inte påvisar någon kromosomavvikelse är sannolikheten att fostret trots detta har en trisomi (så kallat falskt negativt resultat) mycket låg (ca 1 av 10 000 analyser för trisomi 13/18/21 beräknas vara falskt negativ). Tvillinggraviditet: Av de sammanställningar som hittills gjorts så verkar NIPT fungera tillförlitligt även vid tvillinggraviditeter, men erfarenheten är fortfarande begränsad. Det går därför inte att utesluta att tillförlitligheten av NIPT är något lägre än det som anges för enkelbörd ovan. Faktaruta Säkerheten i NIPT-analysen NIPT-metodens förmåga att korrekt identifiera fall med kromosomavvikelse är hög (metodens sensitivitet). För trisomi 21 är sensitiviteten över 99% och något lägre för trisomi 13 och trisomi 18. Falskt negativa resultat är mycket ovanliga, varför ett negativt NIPT-resultat i normalfallet inte föranleder någon ytterligare åtgärd. Även metodens förmåga att korrekt utesluta kromosomavvikelse hos foster är hög (metodens specificitet), 99% eller högre för alla trisomier. Trots hög specificitet så förekommer falskt positiva resultat. Sannolikheten att ett positivt testresultat verkligen är sant beror av andelen sant positiva resultat bland de testade och brukar anges som positivt prediktivt värde (PPV). PPV vid NIPT kan vara betydligt högre än 80% i en population gravida med förhöjd sannolikhet för trisomi och har i flera studier varit ner emot 50% i en population gravida med genomsnittlig sannolikhet för trisomi, vilket innebär att upp till vartannat positivt prov kan vara falskt positivt. Till följd av detta rekommenderas att ett positivt testresultat vid NIPT konfirmeras med invasiv provtagning och analys med QF-PCR eller kromosomanalys. Vid bestämning av könskromosomerna, XX eller XY, ligger sensitiviteten på 98-99%. För könskromosomavvikelser finns ett mindre statistiskt underlag men sannolikt är sensitiviteten något lägre än för trisomi 21. Var kan NIPT göras? Alla landsting erbjuder inte NIPT och testet brukar endast erbjudas till vissa grupper, t.ex. gravida där KUB-undersökning visat ökad sannolikhet för kromosomavvikelse. I Stockholms läns landsting kan Klinisk Genetik, Karolinska Universitetssjukhuset ta emot prover för analys. Vissa privata mottagningar erbjuder NIPT mot en kostnad. Länkar SBU Alertrapport ”Analys av foster-DNA i kvinnans blod: icke-invasiv fosterdiagnostik (NIPT) för trisomi 13, 18 och 21” http://sbu.se/sv/Publicerat/Alert/Analys-av-foster-DNA-i-kvinnans-blod-icke-invasiv-fosterdiagnostik-NIPT-for-trisomi-13-18-och-21/ Svensk Förening för Obstetrik & Gynekologi (SFOG) ”Riktlinjer för fosterdiagnostik med NIPT, "non invasive prenatal test" https://www.sfog.se/start/rad-riktlinjer/sfog-riktlinjer/ Tidigare barn med kromosomavvikelse Upprepningsrisken för föräldrar som tidigare fått ett barn/foster med trisomi 21 är oberoende av ålder numeriskt sett låg (0,5 –1%). För andra icke nedärvda kromosomrubbningar som trisomi 13 eller trisomi 18 är upprepningsrisken betydligt lägre (<0,5%).
| ||||||||||||||||||||||||||
| 4. Missbildning upptäckt med ultraljud | ||||||||||||||||||||||||||
|
De flesta av de vanligaste missbildningarna anses ha en multifaktoriell orsak, och upprepningsrisken för förstagradssläktingar brukar anges vara mellan 1-5% beroende på vilken missbildning det gäller. Det finns en rad missbildningar som kan diagnostiseras vid i första hand ultraljudsundersökningar. I vissa fall kan det vara av vikt att veta om ett foster är skadat, utan att man för den skull har för avsikt att göra abort.
En missbildning kan vara av den arten att den kan korrigeras framgångsrikt under förutsättning att den inte förvärras genom en svår förlossning. Flertalet hjärtmissbildningar kan i många fall korrigeras operativt efter födelsen. Den prenatalt ställda diagnosen får då den betydelsen att fostret kan behandlas in utero om det uppvisar tecken på hjärtarytmi eller inkompensation, och en operation kan förberedas.
När man vid ultraljudsundersökning upptäcker att fostret har en eller flera missbildningar är det ofta en fördel att känna till fostrets kromosomuppsättning. Man kan då lättare ange prognos och informera föräldrarna. Resultat av genetisk diagnostik kan ha betydelse för hur graviditeten handläggs och för framtida genetiska vägledning.
Gendosarray
Gendosarray (eller mikroarray) är en relativt ny genetisk teknik som kan detektera små kromosomavvikelser och som med fördel kan övervägas när missbildning upptäckts vid ultraljudsundersökning av fostret. Tekniken har haft avgörande betydelse vid postnatal utredning av utvecklingsavvikelser och har introducerats även för prenatala analyser. Gendosarray bygger på att en persons arvsmassa (DNA), som märkts in med färg, samt ett referens-DNA inmärkt med annan färg tillförs till ett så kallat array-chip (en glasskiva där genetiska kloner som representerar hela arvsmassan är belägna). Det tillförda DNA:t binder till klonerna på glasskivan. Genom datoriserad analys jämförs förhållandet mellan hur mycket av individens DNA respektive referens-DNA´t som bundit in till varje klon och därmed detektera avsaknad respektive tillskott av en liten del av en kromosom, så kallad deletion eller duplikation.
Fördelarna jämfört med traditionell karyotyp är högre upplösning, kortare analystid, samt att riktad FISH-analys för kända mikrodeletionssyndrom inte behöver göras eftersom gendosarray detekterar dessa. Det är i första hand när missbildning upptäckts vid ultraljudsundersökning av fostret som gendosarray används. Vid en utredning där man påvisat en missbildning hos fostret påvisas en kromosomavvikelse som orsak till missbildningen i ca 25% av fallen med karyotyp och ca 30% av fallen om man istället använder array.
Baksidan med gendosarrayanalys jämfört med kromosomanalys är att man upptäcker fler avvikelser i arvsmassan där betydelsen är oklar. Detta fordrar vanligen uppföljning med analys av föräldrarna för att se om de bär på samma förändring. Hur ofta en sådan oklar förändring påvisas beror av vilken typ av array som används. Vid utredning av missbildning hos foster där man använder en standard-array får man räkna med att upp till ca 5% av proverna kommer att behöva kompletterande utredning. Detta riskerar att leda till oro och långdragen utredning.
I vissa länder har man ersatt den prenatala karyotypen med gendosarray även vid andra indikationer, men vinsten med detta är fortfarande oklar och studier visar att det är en marginell vinst i form av fler diagnostiserade fall av kromosomavvikelse vid indikationerna maternell ålder, oro och förhöjd risk enligt KUB-test.
Faktaruta Missar mikroarray något som en klassisk karyotyp skulle ha identifierat? • Balanserad strukturell kromosomavvikelse, vilket i normalfallet inte orsakar symptom men skulle kunna ha betydelse för föräldrarna vid ev framtida graviditet. • Låggradig mosaicism kan undgå såväl mikroarray som klassisk kromosomanalys. Flera studier har visat att array är något bättre på att påvisa låggradig mosaicism än en traditionell kromosomanalys. • Markörkromosomer som endast består av heterokromatin påvisas inte med array men förväntas inte heller ha någon påverkan på fenotypen (<0,2 % av graviditeter med ultraljudsavvikelser). • Triploidi kan missas vid analys med mikroarrayteknik som ej inkluderar så kallade SNPar. Om mikroarrayanalysen föregås av QF-PCR är detta dock inget problem eftersom dessa metoder identifierar triploidi.
| ||||||||||||||||||||||||||
| 5. Riktad fosterdiagnostik vid ärftlig sjukdom | ||||||||||||||||||||||||||
|
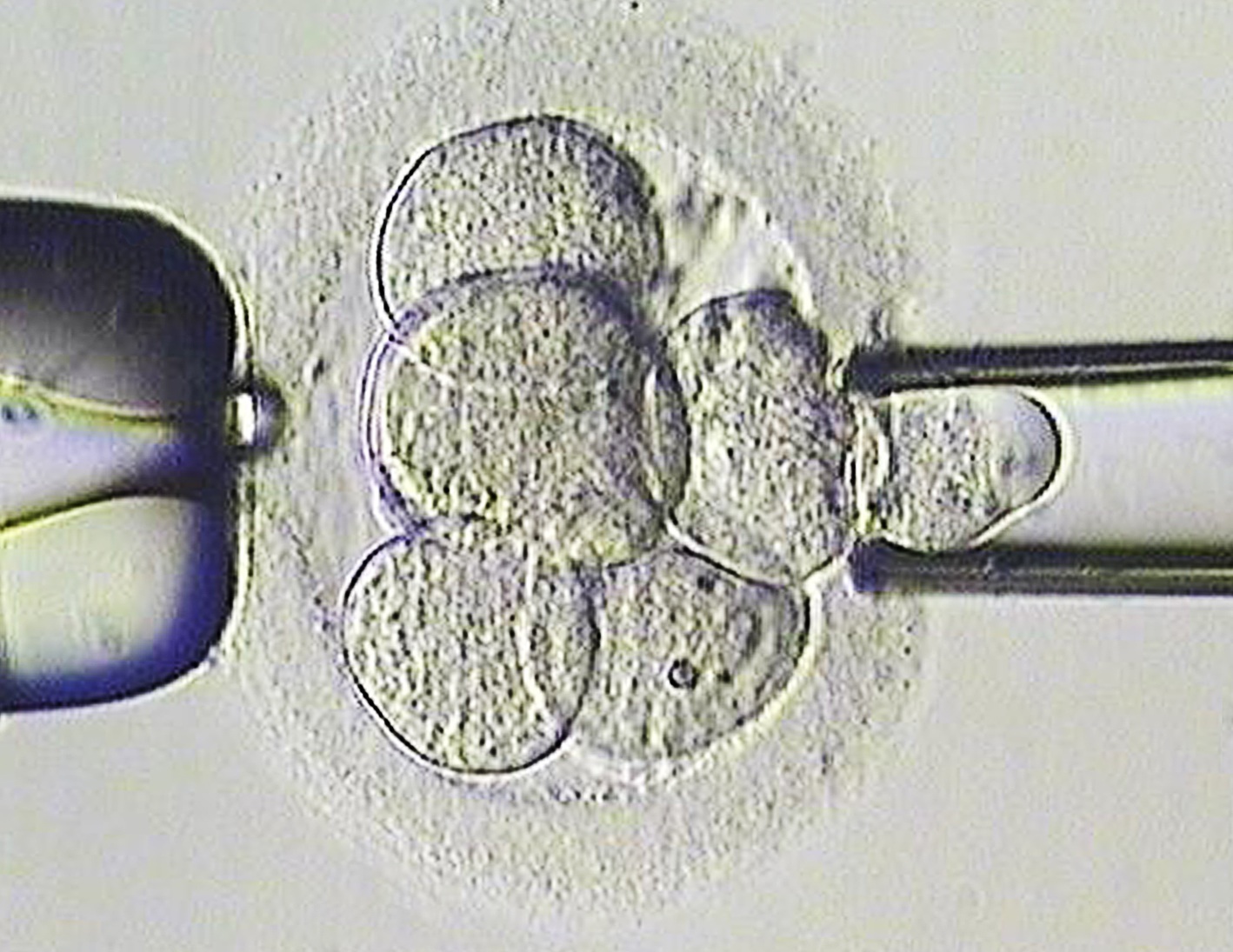
Monogena sjukdomar I det fall det förekommer en ärftlig sjukdom i familjen som den gravida kvinnan o/e hennes partner är bärare av finns det i många fall möjlighet till fosterdiagnostik. Utvecklingen går fort och det tillkommer kontinuerligt nya monogena sjukdomar som kan diagnostiseras. Därför bör det i det enskilda fallet kontrolleras om den aktuella sjukdomen kan diagnostiseras, att sjukdomsanlaget i familjen är identifierat och att kvinna o/e hennes partner är bärare av anlaget genom kontakt med en klinisk genetiker. Förutsättningen för en DNA-baserad fosterdiagnostik är att man tidigare lyckats identifiera en mutation hos den ena eller bägge föräldrarna, eller hos en drabbad släkting eftersom syftet med en sådan diagnostik nästan alltid är att påvisa om fostret har ärvt den aktuella mutationen. Familjära kromosomavvikelser Det är framför allt bärare av balanserade translokationer och inversioner som löper ökad risk att få barn med en obalanserad strukturell kromosomrubbning. Familjära kromosomrubbningar är därför en indikation för fosterdiagnostik. Familjerna upptäcks nästan alltid i samband med födelsen av ett barn med skador som orsakats av en obalanserad kromosomuppsättning eller i samband med en utredning pga upprepade missfall. Ur familjeplanerings- och preventiv synvinkel är det viktigt att hela familjen utreds genetiskt. Bärare av den strukturella kromosomavvikelsen kan då identifieras innan de hunnit få ett skadat barn och erbjudas möjlighet till fosterdiagnostik alternativt preimplantatorisk genetisk diagnostik (PGD). Så väl klassisk kromosomanalys, FISH (fluorescent in situ hybridisering) som gendosarray används för fosterdiagnostik och valet av metod beror av vilken typ av kromosomavvikelse det gäller liksom hur stor avvikelsen är. Preimplantatorisk genetisk diagnostik (PGD) Ett par med en känd ökad risk att få barn med monogen sjukdom eller kromosomavvikelse erbjuds invasiv fosterdiagnostik som vanligen innebär abort om fostret visar sig ha ärvt sjukdomen. Ett alternativ till fosterdiagnostik är preimplantatorisk genetisk diagnostik (PGD), vilket innebär genetisk diagnostik på embryostadiet innan implantationen. Tekniken har varit i kliniskt bruk i Sverige sedan mitten på 1990-talet. I Sverige regleras PGD i lagen om genetisk integritet m.m. (SFS 2006:351). Där framgår det att ”Preimplantatorisk genetisk diagnostik får användas endast om mannen eller kvinnan bär på anlag för en allvarlig monogen eller kromosomalt ärftlig sjukdom, som innebär en hög risk för att få ett barn med en genetisk sjukdom eller skada.” Det finns uppenbara fördelar med PGD, t.ex. att ett par med förhöjd risk att få barn med en allvarlig genetisk sjukdom kan påbörja en graviditet i vetskap om att fostret inte ärvt sjukdomen och därmed undvika abort. Metoden dras dock fortfarande med vissa begränsningar: Provrörsbefruktning (in vitro fertilisering, IVF), som är en av förutsättningarna för PGD, innebär en begränsad chans att uppnå graviditet. Vid PGD är chansen att bli gravid cirka 30-40 % vid en behandlingscykel, och resultatet är beroende av vilken sjukdom det rör sig om. Så väl provtagning på embryot, s.k. embryobiopsi, som genetisk diagnostik på en enstaka cell gör att metoden är tekniskt komplicerad. Genetisk diagnostik på en enstaka cell innebär dessutom vanligen individuell utprovning av genetisk diagnostik för det enskilda paret. Sammantaget gör dessa faktorer att PGD är en resurskrävande verksamhet samtidigt som den kan vara enda möjligheten för vissa par att få biologiska barn. Faktaruta PDG-behandlingens tre faser PGD-behandlingen kan delas in i tre faser: hormonstimulering/äggplockning, embryobiopsi och genetisk diagnostik. Hormonstimulering och äggplockning Den inledande fasen hormonstimulering och äggplockning skiljer sig inte nämnvärt från traditionell provrörsbefruktning. I korthet innebär det att kvinnan behandlas med hormoner för att flera ägg ska mogna samtidigt. När äggblåsorna i äggstockarna mognat kan s.k. äggplockning göras och därefter befruktas äggen med mannens spermier. Embryobiopsi Embryobiopsi för PGD kan utföras vid olika tidpunkter i den tidiga embryoutvecklingen. Polkroppsbiopsi, biopsi på klyvningsstadiet (cleavage stage, cirka 8-cellstadiet) och blastocystbiopsi är de metoder som används. Embryobiopsi på klyvningsstadiet utförs tre dagar efter befruktningen när embryona består av 6–10 celler. Vid biopsin avlägsnas en eller två celler från varje embryo som sedan används för analys (Figur 7). Vid blastocystbiopsi görs biopsin dag 5 eller 6 och 5-10 celler kan då tas till analys. Genetisk diagnostik Vid PGD har man att ta hänsyn till att analysen sker på enstaka celler, vilket innebär speciella förutsättningar och vissa begränsningar. Därmed skiljer sig den genetiska analysen vid PGD till viss del från fosterdiagnostik i övrigt. Det kan i enstaka fall t.ex. innebära att en sjukdom inte är möjlig att diagnostisera på embryostadiet och att ett par därför är hänvisat till traditionell fosterdiagnostik. Detta har förstås betydelse för informationen till de par som kan komma ifråga för behandling.
Figur 7. Embryobiopsi på klyvningsstadiet utförs tre dagar efter befruktningen när embryot består av 6–10 celler. I zona pellucida görs ett hål med laserteknik. Genom detta hål kan sedan en eller två av embryots celler (blastomerer) sugas ut för att ge material till den genetiska analysen. Efter biopsin förs embryot tillbaka till inkubatorn i avvaktan på att analysen ska bli klar.
För diagnostik av monogena sjukdomar vid PGD gör man i majoriteten av fallen en s.k. kopplingsanalys då specifik diagnostik av en mutation i många fall inte är möjlig till följd av den begränsade mängden DNA från en enstaka cell. Kopplingsanalysen vid autosomalt recessiva sjukdomar kräver att det finns DNA från en individ med sjukdomen i släkten. Vid autosomalt dominanta sjukdomar kräver kopplingsanalysen att det finns DNA från mer än en individ med sjukdomen i släkten.
För att diagnostisera ärftliga kromosomavvikelser vid PGD används array-CGH analys alternativt FISH på celler i interfas. Med dessa tekniker kan man diagnostisera enbryon med obalanserad kromosomuppsättning men man kan inte skilja mellan ett embryo som har normal kromosomuppsättning och ett embryo som är balanserad bärare liksom sin bärande förälder. Detta torde inte ha någon större betydelse då båda fallen ger ett friskt barn.
PGD-HLA PGD kan också användas för att öka chanserna att få ett HLA-kompatibelt syskon till ett svårt sjukt barn som är i behov av benmärgstransplantation, s.k. PGD-HLA. Det kan t.ex. röra sig om en familj där föräldrarna är bärare av anlag för beta-talassemi och har ett barn med beta-talassemia major som skulle kunna botas med blodstamceller från ett syskon. I normalfallet räcker det med att ta till vara blodstamcellerna från navelsträngen vid förlossningen. För att få utnyttja PGD-HLA i Sverige krävs Socialstyrelsens tillstånd i varje enskilt fall. Följande förutsättningar bör dessutom vara uppfyllda för att detta ska komma ifråga: Behandlingen ska avse en monogent nedärvd sjukdom som kan diagnostiseras med hjälp av PGD i den aktuella familjen; alternativa behandlingar saknas; HLA-typning av familjemedlemmar har visat att det befruktade äggets HLA-typ kan förutsägas; behandlingen av det sjuka barnet kan vänta och sjukdomen har ett sådant förväntat förlopp att förfarandet med PDG-HLA passar.
Preimplantatorisk genetisk screening Numeriska kromosomavvikelser är vanliga i humana embryon under de första celldelningarna och även en vanlig orsak till tidiga missfall. Detta har lett till antagandet att denna typ av kromosomavvikelser är en av orsakerna till de relativt låga graviditetsresultaten vid assisterad befruktning. Detta har i sin tur lett till att man inlett försök med s.k. preimplantatorisk genetisk screening (PGS). PGS innebär att man med avsikten att öka graviditetschanserna vid assisterad befruktning analyserar embryot avseende ett utvalt antal kromosomer för att utesluta aneuploidi och därmed kunna återföra embryon med normal kromosomuppsättning. Tidigare randomiserade kontrollerade studier har inte kunnat fastställa att PGS ökar chansen att få barn med den metodologi och de indikationer som hittills använts. Studier utförda de senaste åren indikerar att det kan finnas vinster med PGS. Flera större studier pågår. I Sverige får PGS för närvarande endast användas inom ramen för forskningsprojekt som godkänts i en etikprövningsnämnd.
| ||||||||||||||||||||||||||
| Uppdaterad: 2015-10-29 | ||||||||||||||||||||||||||
Medicinsk redaktör Magnus Nordenskjöld. Kommentarer till Rula Zain.
© 2024 MedSciNet AB. All rights reserved. Legal Notices.
.png)